Бережная микроскопия: путь к новым возможностям

С каждым годом ученые получают новые возможности увидеть, приблизить и изучить все более маленькие объекты. Это происходит благодаря эволюции технического оснащения лабораторий, в частности, систем формирования изображений для микроскопии.
В декабре прошла церемония награждения лауреатов Нобелевской премии по физиологии и медицине за 2017 год. Обладателями премии стали профессора Джеффри Холл, Майкл Розбаш и Майкл Янг. Они изучали молекулярные механизмы, регулирующие суточные ритмы организма. Холл, Розбаш и Янг сумели определить гены, отвечающие за «биологические часы», и проанализировать их работу.
То, что мы называем «биологическими часами», является механизмом реакции организма на смену дня и ночи на планете, позволяющим ему приспособиться к изменившимся условиям. Кровяное давление, уровень гормонов, температура тела, циклы сна – все это различается у всех живых организмов в течение суток.
Можно сказать, что изучение «биологических часов» началось в середине 18 века, когда французский астроном и физик Жан Жак де Меран заметил способность растения «Мимоза стыдливая» складывать листья на ночь и распрямлять их утром, даже если оно было помещено в полную темноту.
Предположения о том, что эти ритмы имеют внешнюю природу, были окончательно опровергнуты в 20 веке во время экспериментов в космосе, где были абсолютно исключены какие-либо геофизические воздействия на клетки. Исследователи стали искать гены, отвечающие за данный механизм.
Сеймур Бензер и Рональд Конопка изучали мушек-дрозофил на разных стадиях развития и выяснили, что мутации суточной ритмики передаются потомству, а следовательно, заложены генетически. К активной работе над изучением «биологических часов» подключились исследователи Джеффри Холл и Майкл Розбаш и параллельно лаборатория профессора Майкла Янга. Первым был идентифицирован ген period, определяющий суточный ритм. Это был прорыв.
За ним произошли открытия и других генов, отвечающих за смену циклов.
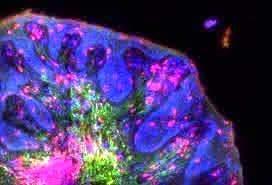
Здесь очень важно обратить внимание на то, благодаря чему это стало возможным: в распоряжении ученых были микроскопы DeltaVision, в которых применяется метод распределенного освещения, что решает сразу несколько проблем микроскопического исследования: возрастает разрешающая способность и коэффициент увеличения, образцы же остаются при этом живыми. В других микроскопах, освещенные единственным источником, находящиеся вне организма клетки быстро погибали, буквально «поджаривались» в лучах света. Таким образом, до появления DeltaVision время у исследователей на изучение живых клеток было жестко ограничено, и такие наблюдения, как перемещения белков внутри клетки в течение 24-часового цикла, были фантастикой.
Итак, механизм циркадного цикла стал ясен. Белок TIM (ген timeless) связывается с белком PER (ген period), который вырабатывается ночью и накапливается в цитоплазме, и вместе они могут попасть в ядро клетки. После этого в организме блокируется действие гена period, и оба белка разрушаются. За своевременное разрушение PER и TIM отвечает другой ген, открытый Розбашем и его коллегами, – cryptochrome. Благодаря ему концентрация PER и TIM падает на свету и возрастает вечером и ночью. Цикличность процесса обеспечивается присутствием найденного Янгом белка – DBT (ген doubletime), который «отлаживает» ритм в соответствии с 24-часовым циклом, задерживая накопление PER, таким образом, при сбоях темной и светлой фаз цикл сохраняется.
Итогом кропотливой 50-летней работы Холла, Розбаша и Янга, уходящей корнями в 18 век, стала формулировка модели транскрипционно-трансляционной осцилляции, Нобелевская премия и шанс помочь людям, у которых работа биологических часов нарушена из-за мутаций в генах.
Микроскопы DeltaVision способствовали и другим важным открытиям последних лет. Нобелевская премия 2001 года была отдана Полу Нерсу и Ли Хартвеллу, которые изучали деление клеток, используя функцию маркирования бактерий флуоресцентными молекулами для освещения скрытых объектов.
Лауреат Нобелевской премии 2009 года Элизабет Блэкберн изучала хромосомы. Благодаря такой особенности микроскопа DeltaVision, как автоматизированный столик, который позволяет сканировать образец в трех измерениях, зафиксировать на этих осях координаты объектов, находящихся на изучении, а затем проанализировать данные, она смогла обнаружить концевые участки хромосом и открыла механизмы их защиты от биологического старения.
Изучение живых клеток с помощью микроскопов DeltaVision от GE Healthcare имеет ряд неоспоримых преимуществ, что подтверждают сделанные с их помощью нобелевские открытия. Внутри системы поддерживается особая среда, имитирующая параметры живого организма, и жизнедеятельность клеток может сохраняться в течение нескольких недель. Сверхсовременное программное обеспечение и оборудование позволяет наблюдать за живыми объектами в режиме 3D даже за пределами дифракционного барьера Эрнста Аббе. Степень разрешения высока настолько, что можно рассматривать даже субклеточные структуры.
Самый совершенный на сегодня микроскоп – это система формирования изображений GE DeltaVision Elite. Методы исследования включают флуоресценцию полного внутреннего отражения (TIRF), резонансный перенос энергии флуоресценции (FRET), фотокинетику, дифференциально интерференционный контраст (DIC), флуоресценцию с широким полем обзора, замедленную фотосъёмку живых клеток и многоточечное отслеживание клеток. DeltaVision Elite обладает функцией деконволюции, оптимизированной для слабых сигналов и визуализации живых клеток.
Автоматический контроль состояния рабочей среды безупречен. Настройка эксперимента и получения данных проста и многомерна. Благодаря модульной конструкции мощность системы можно наращивать. Все это позволит исследователям изучать процессы, происходящие в живых клетках, буквально в мельчайших подробностях и совершать новые революционные открытия.
13:39 Сегодня

 Безопасность и Оборона
В ГИБДД рассказали, кого будут штрафовать на 9 мая
Безопасность и Оборона
В ГИБДД рассказали, кого будут штрафовать на 9 мая Транспорт
Участились случаи обмана на вторичном рынке автомобилей
Транспорт
Участились случаи обмана на вторичном рынке автомобилей Песков: «Путин готов обсуждать ситуацию вокруг Украины»
Песков: «Путин готов обсуждать ситуацию вокруг Украины» В Роспотребнадзоре раскрыли способ выявлять Covid-19 на самых ранних стадиях
В Роспотребнадзоре раскрыли способ выявлять Covid-19 на самых ранних стадиях Россия доработает свою внешнеполитическую концепцию
Россия доработает свою внешнеполитическую концепцию Сергей Шойгу потребовал у Великобритании объяснить присутствие ее спецназа на Украине
Сергей Шойгу потребовал у Великобритании объяснить присутствие ее спецназа на Украине События
В СВР рассказали об активной подготовке Украины к войне
События
В СВР рассказали об активной подготовке Украины к войне Россияне смогут получить QR-код по результатам теста на антитела
Россияне смогут получить QR-код по результатам теста на антитела В Кремле опровергли информацию о «сделке» между Путиным и Макроном по Украине
В Кремле опровергли информацию о «сделке» между Путиным и Макроном по Украине В РФ предложили разрешить любую самооборону для защиты жилища
В РФ предложили разрешить любую самооборону для защиты жилища




